3) Estrutura e estabilidade dos radicais
 |
| Radicais livres que têm um efeito nocivo para as células e são tidos como causadores de arteriosclerose, catarata, tumores, doenças da pele e doenças reumáticas. |
As estruturas alquil podem estar em três situações bem distintas.
Baseadas nessas configurações, o orbital 2pz pode conter zero, um ou
dois elétrons.
Figura 8: Orbitais pz do Carbocátion (a esquerda), carbono radical (ao centro) e carbânio (a direita)
Nas figures acima temos a esquerda um carbocátion (carbono deficiente
de um elétron, ou seja, o orbital 2pz se encontra vazio), no meio temos
um carbono radical (possui um elétron no orbital 2pz) e a direita tem
um carbânio (quando o carbono está com um elétron a mais, estando o
orbital 2pz totalmente preenchido). No carbono radical esse elétron
livre pode passar para os orbitais de carbonos adjacentes uma vez que a
estrutura seja linear e os orbitais “p” estejam próximos, o que ocorre
bem quando os carbonos estão hibridizados em sp2 (figura 9), assim como
ocorre com os carbocátions e com os carbânios. Essa deslocalização do
elétron pela molécula é conhecida como ressonância e é um fator que
ajuda na estabilização molecular.
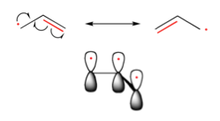
Figura 9: Deslocalização do elétron no propeno radical
Outra definição importante a ser estudada é a hiperconjugação
também conhecido como efeito Baker-Nathan. Ela foi utilizada pela
primeira vez por John W. Baker e W.S. Nathan em 1935, onde eles
definiram que a hiperconjugação é a interação σ com uma rede de ligações
π. Podendo ainda ser descrita como a interação entre orbitais
eletrônicos, onde um deles corresponde a ligação sigma.
Figura 10: Representação dos orbitais σ e π na hiperconjugação
A estabilidade dos radicais livres se deve ao efeito de hiperconjugação que ocorre quando os orbitais preenchidos do carbono se aproxima do orbital do carbono vizinho semi-preenchido (carbono radical). Quando há essa aproximação, corre uma sobreposição de orbitais que faz o orbital molecular formado possuir uma energia menor estabilizando assim o radical (figura 10). Como exemplo, podemos mostrar as figuras 12 e 13 que são os radicais etila e isopropila.
Figura 11: estrutura trigonal plana do radical metila
Figura 12: interação dos orbitais do radical na etila
Figura 13: interação dos orbitais do radical na isopropila
A ordem de estabilidade para os radicais livres são:
radical terciário > radical secundário > radical primário > radical metila.
A instabilidade da metila é dada pelo fato de não haver um orbital de
carbono na proximidade para que o efeito de hiperconjugação a
estabilize. Quando nos referimos aos radicais aromáticos, dizemos que a
estabilidade é dada pelo efeito de ressonância que é mostrado na forma
de uma deslocalização dos elétrons π que estão no anel de forma a
estabilizar o elétron no orbital p semipreenchido (figura 14). Quanto
maior a possibilidades de ressonância, mais é o efeito estabilizante.
Figura 14: Ressonância do elétron no anel benzênico
Com base nos efeitos de hiperconjugação e ressonância, podemos entender que os resultados de diversos tipos de geometria:
3.1 Radicais Metil
As deduções sobre a estrutura pode também ser obtidas a partir do
estudo da estereoquímica de reações envolvendo radicais intermediários.
Várias possibilidades estruturais podem ser consideradas. Se a discussão
está limitada a grupos alquil, as possibilidades incluem uma estrutura
rígida piramidal, rapidamente invertendo em estruturas piramidais, ou
uma estrutura planar.
Figura 15: estrutura piramidal invertendo e se convertendo em uma estrutura trigonal plana
Diversos estudos incluindo, espectroscopia de ressonância
paramagnética eletrônica, espectroscopia de infravermelho,
espectroscopia de microondas e cálculos teóricos indicam que após a
inversão da estrutura piramidal ela se torna totalmente planar, uma vez
que se considera que o orbital está hibridizado na forma sp2 com o
elétron desemparelhado ocupando o orbital 2pz que está perpendicular as
três ligações.
3.2 Radicais Alquil Piramidais:
A geometria piramidal se deve a interação dos orbitais do carbono com
os dos hidrogênios do grupo. Há uma interação hiperconjugativa entre o
orbital semi-preenchido e o hidrogênio que se encontra alinhado com ele.
As ligações C-H anti dos elétrons não-emparelhados são mais longas do
que aqueles que são gauche. Os hidrogênios na posição anti, possuem o
máximo de hiperconjugação com o orbital contendo o elétron não
emparelhado e fazem uma maior contribuição.
Figura 16: Interação do orbital semipreenchido com o hidrogênio
3.3 Radicais Alquil Piramidais com Substituinte
A geometria dos radicais também é afetada significativamente por
grupos substituintes que podem atuar como doadores de elétrons. A adição
de um substituinte flúor ou oxigênio favorece uma estrutura piramidal.
Essa repulsão acontece devido à interação do orbital p semi-preenchido e
pelos orbitais preenchidos dos elétrons não ligantes. Devido a esse
tipo de repulsão desses orbitais há o favorecimento da estrutura
piramidal e não planar como acontece com os hidrogênios.
Outro fator que reforça a geometria piramidal é a forte estabilização
do orbital p do carbono e dos orbitais σ* anti-ligante das ligações C-F
ou C-O. Essa estabilização é mais favorecida quando esta estrutura é
colocada na forma de pirâmide.
Figura 17: estrutura piramidal estabilizada quando os ligantes são diferentes de hidrogênio
Hoje conduzimos muitos estudos para deduzir a geometria dos radicais.
Um dos métodos mais estudados é examinando a estereoquímica das reações
desses radicais. O estudo neste nível promove a geração de um radical
com um carbono que é um centro estereogênico. Se a estrutura for plana
ou houver uma rápida inversão das estruturas piramidais (como mostrada
na figura da página anterior) esta reação estará encaminhada para uma
racemização. Sendo assim, se houver uma estrutura rígida piramidal
seremos conduzidos a uma configuração de produto semelhante à estrutura
original.
3.4 Radicais Cíclicos:
Moléculas cíclicas nos permitem obter resultados sobre a
estereoquimica sem passarmos por um centro de quiralidade. Isso ocorre,
pois as reações que começam puras (tanto cis quanto trans) terminam em
misturas enantioméricas. Esse fato acontece devido a inversão
axial-equatorial existente nos radicais ciclohexanos, pois a barreira de
energia dessas inversões é relativamente baixa (~5,6 kcal/mol)
acontecendo então mais rapidamente que propriamente a reação desejada
como podemos ver abaixo:
Figura 18: Inversão axial-equatorial dos ciclohexanos
3.5 Radicais em Estruturas do tipo Ponte
Nesses tipos de sistemas devemos lembrar que existe uma forte
resistência a formação de carbocations em determinados centros porque
temos uma estrutura extremamente rígida, impedindo muitas movimentações
desejadas. Para este tipo de radical também possuímos uma estrutura do
tipo piramidal, como observamos na figura 19:
Figura 19: Radicais do tipo ponte
Possuindo estruturas desse tipo reações desses radicais acontecem com
muito mais facilidade e possuem cinéticas de maior intensidade. Outro
detalhe que podemos observar é que de todas as estruturas alquil
observadas apenas a metil possui uma estrutura plana, sendo todas as
outras favorecidas pra uma estrutura piramidal.
3.6 Radicais Alílicos
Para os radicais alílicos (estruturas com a distribuição
H2C=CH-CH2R), espera-se que se adote uma estrutura plana para se
maximizar o deslocamento π. No entanto, o radical vinil, (CH2 = CH.) é
encontrado tanto por métodos experimentais quanto teóricos com um ângulo
de 137° na ligação C-C-H, sendo, portanto levemente dobrado. Esse
efeito acontece devido a influencia do substituinte na geometria da
estrutura. Conjugação com substituintes aceptores favorecem uma
estrutura linear, pois o orbital do substituinte alinha perfeitamente
com o orbital semi preenchido do radical, ao passo que, substituintes
doadores favorecem uma estrutura dobrada. Essa premissa não foi
comprovada experimentalmente, mas resultados de estereoquimica e
cálculos teóricos mantém a base de que é uma estrutura dobrada.
Figura 20: análogo a um radical alílico
3.7 Radicais Alquenil Substituido
Para esse tipo de radical existe uma indicação da formação de centros
trigonais com rápida interconversão com seu isômero geométrico. Isso
implica numa mistura dos isômeros E e Z do seu precursor no produto
final. Isso ocorre devido à passagem pelo intermediário radical alquenil
que possui uma barreira de inversão baixa passando quase por uma
hibridização sp (linear).
Figura 21: Estrutura dos orbitais do radical alquenil































0 comentários:
Postar um comentário