2) Formação
 |
O excesso de radicais livres no organismo pode causar o envelhecimento precoce |
Pela definição do dicionário radical livre é um fragmento molecular
que leva um ou mais elétrons desemparelhados e é, portanto, altamente
reativo. Isso acontece durante a quebra das ligações químicas que podem
ocorrer de forma homolítica ou heterolítica. Na quebra heterolítica há a
formação de cargas opostas nos átomos que se separaram uma vez que um
deles fica com o par de elétrons e o outro perde (cátions e ânions).
Na quebra homolítica não há formação de cargas, uma vez que cada
átomo fica com um elétron da ligação rompida. Esse átomo neutro com um
elétron desemparelhado é conhecido como radical livre (figura 3).
Figura 3: Formação de radicais pela quebra homolítica
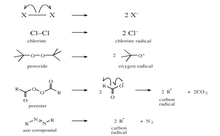
Para este tipo de clivagem homolítica para gerar radicais livres, utilizamos dois métodos menos drásticos:
→Utilização de calor a temperaturas não tão intensas (sendo assim
necessário um composto que tenha uma ligação intrinsecamente fraca). Os
peróxidos são uma fonte comum de intermediários radicais utilizando
calor. Comumente são usados os iniciadores como peróxido de benzoílo,
t-butil-peroxibenzoato, peróxido de di-t-butil e hidroperóxido de
t-butilo. A reação geralmente ocorre a uma temperatura relativamente
baixa (80-100 °C), a ligação oxigênio-oxigênio nos peróxidos é fraca
(~30 kcal/mol) e a energia de ativação para a formação de radicais são
baixos.
Figura 4: Formação de radicais por uma cisão homolítica pela da temperatura
→ Utilização de luz pode levar a fragmentação de um composto, se o
comprimento de onda da luz corresponder a uma energia maior do que a da
ligação a ser clivada, e para levar a mesma ao estado de excitação
eletrônica. Para este tipo de formação de radicais utilizamos como
exemplo os radicais alcoxi de nitrito de alquilo ou hipocloritos.
Figura 5: Formação de radicais por uma cisão homolítica pela luz
No entanto podemos ter gerações de dirradicais. Este grupo pode ser
definido como espécies moleculares que têm dois elétrons
desemparelhados, em que podem ser identificados (mesma multiplicidade
(estado singlete) ou diferentes multiplicidades (estado tripleto)), pelo
menos, dois estados eletrônicos diferentes.
São conhecidos pelas suas reatividades mais altas e tempos de vida
mais curtos. Na definição de dirradicais mais genérica as moléculas têm
uma ligação a menos do que o número permitido pelas regras padrão da
teoria de ligação de valência. Os elétrons podem emparelhar-se com spin
oposto em um orbital molecular deixando o outro vazio.
A partir dessas características podemos ter a formação de
dirradicais, mas que rapidamente reagem para formar outro tipo de
composto. Para este tipo de formação deve-se ter uma dupla ligação
(ligação π) que possa ser quebrada facilmente e levada para o estado
excitado da molécula.
Figura 6: Formação de dirradicais
A cicloaromatização de certos compostos orgânicos altamente
insaturados pode formar dirradicais. No entanto esta reação é altamente
específica e instável como a ciclização de Bergman para o eneodiino:
Figura 7: ciclização do Eneodiino























0 comentários:
Postar um comentário